End-of-life - Simulation von Aufbereitungszyklen
Maximale Lebensdauer von wiederverwendbaren Medizinprodukten
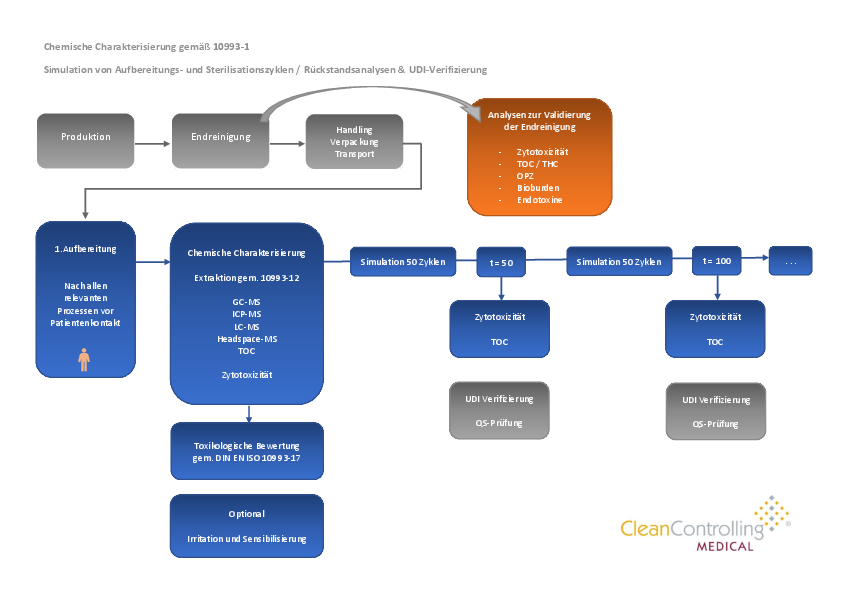
Wiederverwendbare Medizinprodukte müssen im Sinne der Biokompatibilitätsbewertung nach DIN EN ISO 10993-1 auch hinsichtlich der biologischen Sicherheit während der Lebensdauer geprüft werden. Die maximale Lebensdauer wiederverwendbarer Medizinprodukte definiert sich über die Höchstzahl an validierten Wiederaufbereitungszyklen. Um die biologische Sicherheit während der Lebensdauer bewerten zu können, sind Lifecycle-Tests erforderlich.
In Folge der Biokomatibilitäts-Bewertung mit der chemischen Charakterisierung und toxikologischen Bewertung wird das Medizinprodukt mit einer Simulation von mehreren Aufbereitungszyklen nach der validierten Herstelleranleitung unterzogen. Nach einer definierten Anzahl an Aufbereitungszyklen wird z.B. mittels Zytotoxizität und TOC die biologische Sicherheit des Produktes bewertet. Ausserdem spielen hier auch die UDI-Verifizierung sowie die funktionelle QS-Prüfung durch den Hersteller eine wesentliche Rolle. Durch mehrere Zyklen-Reihen wird die maximale Lebensdauer der Produkte ermittelt und festgelegt.
Ablauf der Prüfung
| Aufbereitung: | Zyklen-Reihe typischerweise mit maschineller (RDG) Aufbereitung nach validierten Herstellervorgaben |
|---|---|
| Sterilisation | Zyklen-Reihe Dampfsterilisation nach validierten Herstellervorgaben |
| Biologische Rückstandsanalyse | Z.B. in-vitro-Zytotoxizitätstest nach DIN EN ISO 10993-15 |
| Chemische Rückstandsanalyse | Z.B. TOC-Bestimmung (z.B. von Tensiden) |
Weitere Informationen
Diese Prüfungen sind Bestandteil unserer Akkreditierung, detaillierte Informationen zum Akkreditierungsumfang erhalten Sie hier.
Detaillierte Informationen zu den Prüfverfahren und Prüfnormen finden Sie in unserer Infothek.
Bei weiteren Fragen helfen Ihnen gerne die Ansprechpartner aus unserem Vertrieb weiter.
Newsletter Anmeldung