Prüfnormen zu Zytotoxität & Biokompabilität
Testung der Biokompatibilität durch unser akkreditiertes Prüflabor für Medizinprodukte
Die CleanControll Medical GmbH & Co. KG ist Ihr zuverlässiger Partner, wenn es darum geht, die Biokompatibilität von Produkten gemäß den Vorgaben der DIN EN ISO 10993 festzustellen und nachzuweisen. Unser akkreditiertes und ZLG sowie GLP anerkanntes Prüflabor für biologische und mikrobiologisch-hygienische Prüfungen von Medizinprodukten bietet Ihnen die notwendige Sicherheit bei der Produktentwicklung und im Prozessdesign von Herstellungs- und Verpackungsprozessen.
Was bedeutet Biokompatibilität?
Als biokompatibel werden in der Medizin Materialien oder Werkstoffe bezeichnet, von denen bei direktem Kontakt mit lebendem Gewebe kein negativer Einfluss auf den Stoffwechsel ausgeht. Die Biokompatibilität spielt daher insbesondere im Bereich der Implantologie eine entscheidende Rolle. Die hier eingesetzten Medizinprodukte und Implantate haben über einen langen Zeitraum von Jahren und Jahrzehnten dauerhaft direkten Kontakt mit dem umgebenden Gewebe. Dabei dürfen sie keine Abwehrreaktionen des Immunsystems auslösen, sie müssen also innert sein.
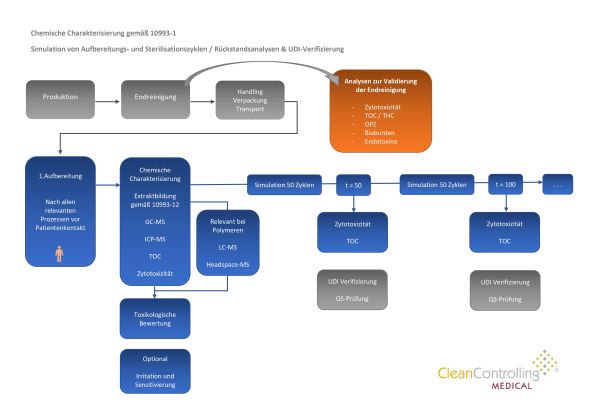
Gemäß den gesetzlichen Vorgaben des Medizinproduktegesetzes müssen Hersteller von Medizinprodukten diese vor dem Inverkehrbringen umfassenden Prüfungen unterziehen, die dem Schutz des Patienten dienen. Unser akkreditiertes Prüflabor bietet Prüfungen zur Zytotoxität und Biokompatibilität nach DIN EN ISO 10993 – Biologische Beurteilung von Medizinprodukten an.
Diese Norm ist vor allem für Hersteller von Medizinprodukten und für Prüflabore relevant. Ihr Ziel ist es, die biologische Verträglichkeit bzw. Körperverträglichkeit von verschiedenen Materialien zu bewerten. Sie gilt nicht nur für fertige Produkte, sondern auch für Ausgangsstoffe, aus denen Medizinprodukte gefertigt werden.
Außer der biologischen Prüfung beschreibt die Norm auch physikalisch-chemische Prüfungen und Analysen von gelösten Stoffen und Substanzen und herauslösbaren Substanzen und deren toxikologischen Bewertung.
Die DIN EN ISO 10993 besteht aus mehreren Teilen. Unser Prüflabor bietet Prüfungen der In-vitro-Zytotoxizität nach DIN EN ISO 10993-5 und erfüllt im Übrigen die folgenden Prüfnormen:
- DIN EN ISO 10993-1 Biologische Beurteilung von Medizinprodukten – Teil 1: Beurteilung und Prüfungen im Rahmen eines Risikomanagementsystems
- DIN EN ISO 10993-12 Biologische Beurteilung von Medizinprodukten – Teil 12: Probenvorbereitung und Referenzmaterialien.
- USP 38 <87> Biological Reactivity Tests, In Vitro.
- DIN EN ISO 10993-17 Biologische Beurteilung (Extractables)
- DIN EN ISO 10993-18 Chemische Charakterisierung
Wie werden Biokompatibilität und In-vitro-Zytotoxität getestet?
Als Zytotoxizität wird die Eigenschaft einer chemischen Substanz bezeichnet, lebende Zellen und Gewebe zu schädigen. Die Prüfung auf Zytotoxizität stellt eines der wichtigsten Prüfverfahren bei der biologischen Beurteilung von Medizinprodukten und der Bewertung der Biokompatibilität dar. Der In-vitro-Zytotoxizitätstest nimmt hierbei einen besonderen Stellenwert ein, denn er erfasst jede Art von zytotoxischer Wirkung eines Produktes, ohne dabei die genaue Ursache zu spezifizieren.
Für diesen Test werden Bindegewebszellen, sog. Fibroblasten, eingesetzt, die eine besonders hohe Sensitivität gegenüber toxischen Substanzen aufweisen. Die Zellen werden entweder mit dem Medizinprodukt/Implantat oder mit einem Extrakt des Produktes für den Zeitraum von mehreren Tagen inkubiert. Am Ende der Inkubation werden die Zellen unter dem Mikroskop auf morphologische Veränderungen sowie auf ein verändertes Wachstumsverhalten hin untersucht und anschließend gefärbt, um die genaue Zellanzahl quantifizieren zu können.
Aus dem Verhältnis von mit dem Produkt oder Material in Kontakt geratenen Zellen zu einer Vergleichsgruppe von Kontrollzellen lässt sich der Einfluss des Produktes oder Materials auf das Zellwachstum (Proliferation) ermitteln. Zudem können so Aussagen über eine mögliche Wachstumshemmung des Produktes oder Materials getroffen werden.
Ein zytotoxischer Effekt kann hierbei durch das Produkt selber (Fertigungsmaterial, Beschichtung), durch auf der Oberfläche befindliche Verunreinigungen oder durch Rückstände (z. B. von Reinigungs- oder Desinfektionsmitteln) ausgelöst werden. Daher müssen im Falle des In-vitro-Nachweises einer Zytotoxizität weitergehende Prüfungen durchgeführt werden, mit denen die exakte Ursache des zytotoxischen Effektes ermittelt werden kann.
Prüfung auf In-vitro-Zytotoxizität und Biokompatibilität durch unser akkreditiertes und GLP anerkanntes Labor
Die CleanControlling Medical GmbH & Co. KG ist ein gemäß DIN EN ISO/IEC 17025 akkreditiertes und nach GLP anerkanntes Prüflabor für Sauberkeitsprüfungen von Medizinprodukten. Wir bieten als ZLG anerkanntes Prüflabor eine große Bandbreite an Prüfungen zur Ermittlung des chemischen, biologischen und partikulären Sauberkeitszustandes von Medizinprodukten.
Die Akkreditierung durch die Deutsche Akkreditierungsstelle nach DIN EN ISO 17025:2018 im Bereich Medizinprodukte bestätigt, dass unser Prüflabor international geltende Qualitäts- und Kompetenzanforderungen erfüllt. Hierdurch ist sichergestellt, dass von unserem Prüflabor ermittelte Prüfergebnisse international vergleichbar sind und anerkannt werden. Bei Validierungen und in Zulassungsverfahren ist die Beauftragung eines akkreditierten Prüflabors zwingende Voraussetzung, damit die Prüfergebnisse in einem Audit anerkannt werden können.
Unser Prüflabor ist im nationalen GLP-Überwachungsverfahren. Daher wird es regelmäßig daraufhin überwacht, dass die Grundsätze guter Laborpraxis gem. ChemG bzw. 2004/9/EG eingehalten werden. Die GLP (Gute Laborpraxis) ist ein Qualitätssicherungssystem für Labore, die nicht-klinische Prüfungen im Gesundheits- und im Umweltbereich durchführen.
Die GLP-Anerkennung unseres Prüflabors ermöglicht die gegenseitige Anerkennung von Prüfungen, etwa zur Biokompatibilität und Zytotoxizität, durch unser Labor, die entsprechend den Grundsätzen der GLP durchgeführt wurden, von den Zulassungsbehörden der OECD-Mitgliedsstaaten (Europa, USA, Kanada, Japan, Mexiko, Australien sowie weiteren Staaten). Das bedeutet unter anderem, dass die Prüfergebnisse auch von der US-amerikanischen Arzneimittelbehörde FDA akzeptiert werden. Aus diesem Grund erstellen wir sämtliche Prüfergebnisse und Berichte FDA-konform und für den internationalen Einsatz immer zweisprachig, sowohl in Deutsch als auch in Englisch.
Haben Sie Fragen zur Zytotoxizität und Biokompatibilität oder zu unseren anderen Dienstleistungen und Produkten? Wir stehen Ihnen gerne telefonisch zur Verfügung und sind unter der Telefonnummer +49 7465/92 96 78-0 täglich von Montag bis Freitag durchgehend von 07:30-16:30 Uhr erreichbar. Alternativ können Sie auch unser Kontaktformular nutzen, um uns Ihr Anliegen mitzuteilen.
Newsletter Anmeldung